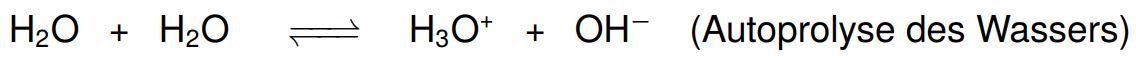Säure-Base-Chemie
Säuren und Basen haben wir bereits in der Mittelstufe kennengelernt. Als kleine Wiederholung hier noch einmal die Definition nach Brønstedt:
- Säuren sind Stoffe, die Protonen (H+) abgeben und werden daher auch Protonendonatoren genannt.
- Basen sind Stoffe, die Protonen (H+) aufnehmen und werden daher auch Protonenakzeptoren genannt.
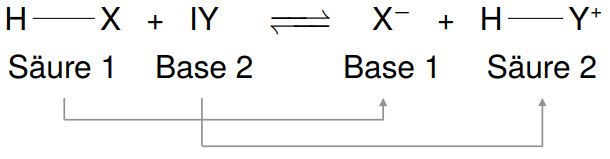
- Eine Säure-Base-Reaktion ist eine chemische Reaktion, bei der ein Protonenübergang von der Säure zur Base stattfindet.
- Eine Protolyse ist eine chemische Reaktion, bei der ein Proton von einer Säure auf eine Base übergeht.
Wichtig: Eine Säure kann nur Protonen abgeben, wenn sie jemand aufnimmt (eine Base) und andersherum.
Bei einer Säure-Base-Reaktion wird aus jeder Säure eine korrespondierende Base und aus jeder Base eine korrespondierende Säure.
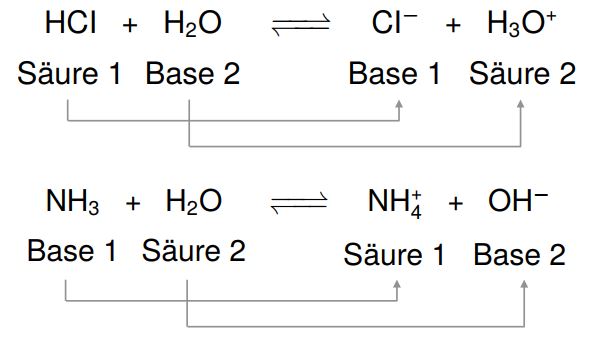
Beispiel: Schwefelsäure und Ammoniak
![]()
Die zur Schwefelsäure korrespondierende Base HSO− 4 hat noch ein Proton, welches sie abgeben kann, daher kann sie als Säure weiterreagieren.
![]()
Da Schwefelsäure zweimal als Säure reagieren kann und daher insgesamt zwei Protonen abgibt, nennen wir sie eine zweiprotonige Säure. Die in der ersten Reaktion entstandene, korrespondierende Base HSO− 4 ist ein besonderer Stoff, da er als Base und als Säure reagieren kann.
Wenn ein Stoff sowohl als Säure als auch als Base reagieren kann, also Protonen abgeben und aufnehmen kann, nennt man diesen Stoff einen Ampholyt. Ob dieser Stoff als Säure oder Base reagiert, hängt vom Reaktionspartner ab. Ein klassisches Beispiel für ein Ampholyt ist Wasser.
Ein solcher Ampholyt kann auch mit sich selbst reagieren. Dieser Vorgang heißt \textbf{Autoprotolyse}. Betrachten wir das bei dem Ampholyt Wasser: