
Batterien und Akkus
Batterien und Akkus basieren auf dem Prinzip der galvanischen Zelle.
Batterien sind sogenannte Primärelemente, bei denen die Redoxreaktion nicht umkehrbar ist. Daher können diese nicht wieder aufgeladen werden. Akkus hingegen sind sogenannte Sekundärelemente. Bei denen wird die Reaktion durch das Anlegen von elektrischem Strom umgekehrt, so dass sie anschließend zur Gewinnung von elektrischen Stroms erneut ablaufen kann.
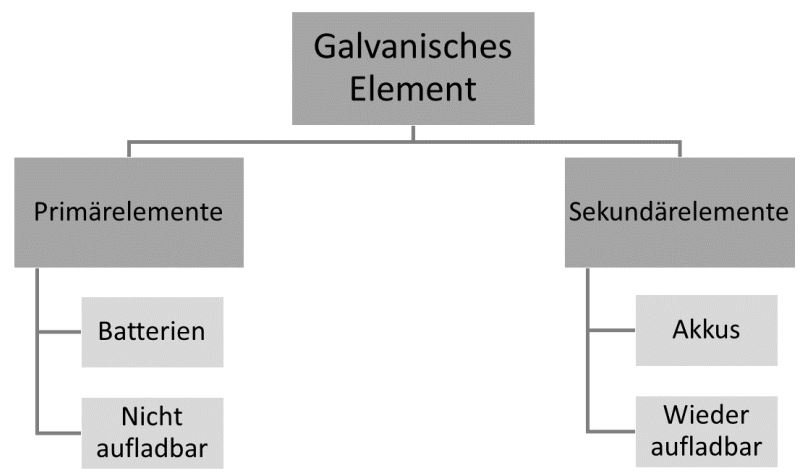
Batterien sind sogenannte Primärelemente, bei denen die Redoxreaktion nicht umkehrbar ist. Daher können diese nicht wieder aufgeladen werden. Akkus hingegen sind sogenannte Sekundärelemente. Bei denen wird die Reaktion durch das Anlegen von elektrischem Strom umgekehrt, so dass sie anschließend zur Gewinnung von elektrischen Stroms erneut ablaufen kann. Akkus sind beliebig oft
wieder aufladbar. Wir betrachten jeweils ein klassisches Beispiel: das Leclanché-Element und den Bleiakku.
Leclanaché-Elemente
Sehr lange Zeit verwendete man als Batterien das Leclanché-Element. Es handelt sich dabei um eine kleine Galvanische Zelle, bestehend aus einer Zinkhalbzelle und einer Braunsteinhalbzelle. Hier läuft, wie in jeder Galvanischen Zelle eine Redoxreaktion ab. Diese betrachten wir noch genauer:
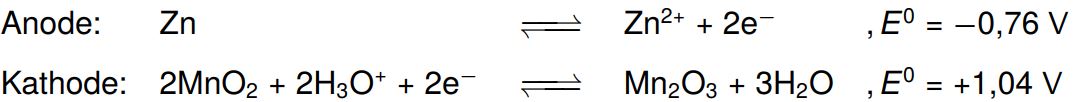
Zink ist ein unedles Metall und gibt daher seine Elektronen sehr gerne ab. Braunstein kann diese Elektronen dann aufnehmen und reagiert zu Mn2O3. Wie bereits als Hinweis genannt, findet diese Redoxreaktion im Sauren statt. Die dafür benötigten Oxoniumionen werden von dem in der Batterie enthaltenen Ammoniumchlorid geliefert:
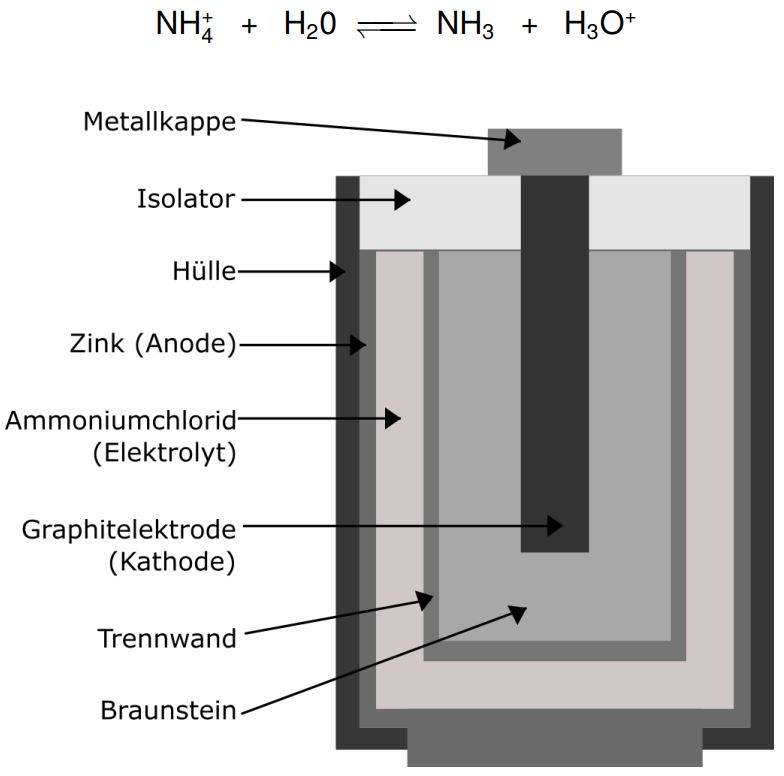
Die Spannung, die durch diese Galvanische Zelle maximal erzeugt werden kann, können wir ebenfalls ausrechnen: E = 1,04 V − (−0,76 V) = +1,80 V
Es gibt mittlerweile Batterien mit anderen Halbzellen, die aus dem Leclanché-Element weiterentwickelt wurden. Diese funktionieren aber auch nach demselben Prinzip, sodass wir nicht jede im Einzelnen zu betrachten brauchen.
Der Bleiakku
Ein Akku kann, im Gegensatz zu einer gewöhnlichen Batterie, wieder aufgeladen werden, da die Redoxreaktionen reversibel sind. Ein klassischer Akku ist der Bleiakku. Dieser besteht aus einer Bleielektrode und einer mit Bleioxid überzogenen Bleielektrode, welche je in Schwefelsäure getaucht werden.
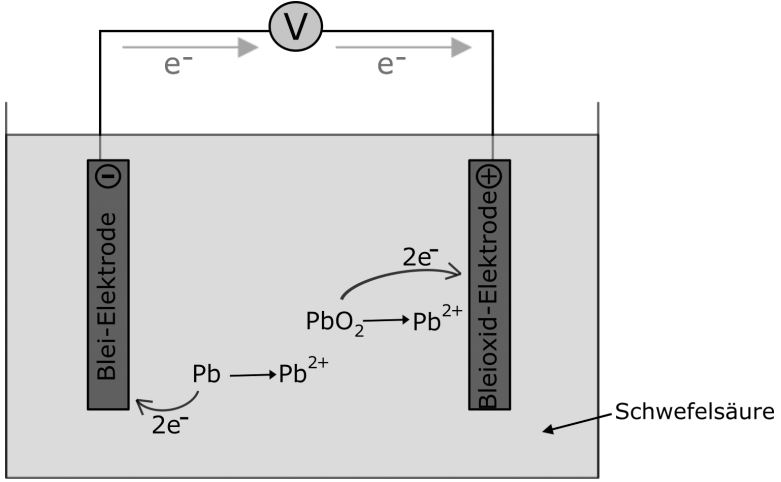
Es laufen folgende Reaktionen bei der Verwendung des Akkus ab:
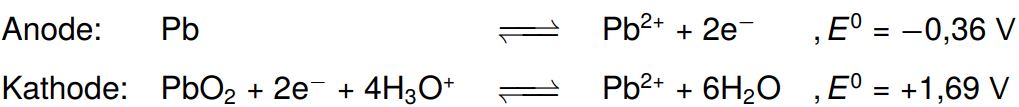
Die Redoxpotenziale weichen stark von den Standardpotenzialen ab, da hier keine 1 molaren Lösungen vorliegen (andere Konzentrationen der Elektrolyte) und der pH-Wert ebenfalls von den Standardbedingungen abweicht. Wenn wir einen entladenen Bleiakku betrachten, stellen wir fest, dass sich an den Elektroden ein weißes Salz absetzt. Es handelt sich hierbei um das schwer lösliche Blei(II)-sulfat.
\begin{align*}
{Pb^{2+}} \ + {SO_4^{2-}} \quad \rightarrow \quad & {PbSO_4}
\end{align*}
Wenn wir den Akku wieder aufladen wollen, legen wir eine Spannung (in diesem Fall von ca. 2,5 V) an, wodurch die Elektrodenreaktionen umgekehrt werden. Es läuft folgende Elektrolyse ab (das im Akku vorhandene Wasser wird nicht elektrolysiert, da die Spannung aufgrund der Überspannung nicht ausreicht, um diese Reaktion in Gang zu setzen):
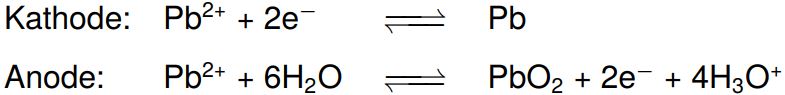
Fassen wir diese Teilreaktionen nun zu einer Gesamtgleichung zusammen, können wir folgende Reaktionen beim Laden bzw. Entladen eines Bleiakkus formulieren:
![]()