Was sind Amine?
Neu!
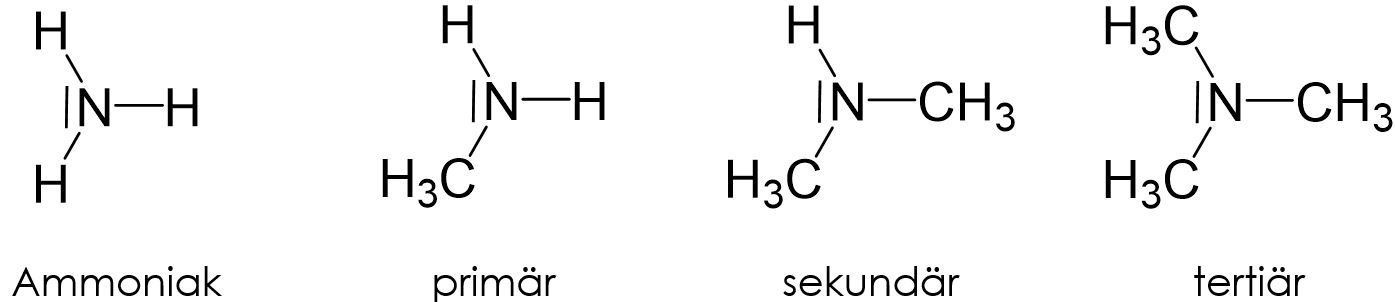
Amine sind organische Verbindungen, die als organische Abkömmlinge von Ammoniak bezeichnet werden.
Ein Amin erhält man, in dem man eines oder mehrerer Ammoniak-Wasserstoffatome durch organische Reste ersetzt. Je nach Anzahl der Reste ergeben sich primäre, sekundäre oder tertiäre Amine.
Basizität Amine
Am Stickstoffatom von Aminen befindet sich ein freies Elektronenpaar. Durch dieses freie Elektronenpaar können Amine ein Proton aufnehmen, weshalb sie als Basen bezeichnet werden.
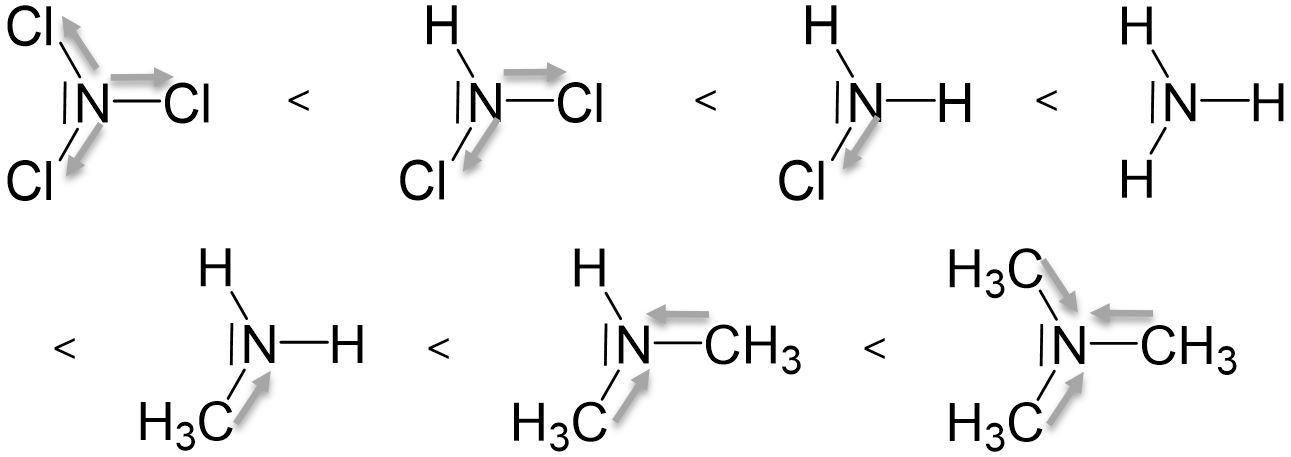
Die Basenstärke eines Amins ist abhängig von den am Stickstoffatom gebundenen organischen Resten. Je mehr elektronenschiebende Substituenten an das Stickstoffatom gebunden sind, desto höher ist die Elektronendichte am Stickstoffatom, und desto leichter teilt es sein freies Elektronenpaar mit einem Proton. Daraus resultiert eine höhere Basizität.
Je mehr elektronenziehende Substituenten an das Stickstoffatom gebunden sind, desto geringer ist die Elektronendichte am Stickstoffatom, und desto weniger teilt es sein freies Elektronenpaar mit einem Proton. Die Basizität wird verringert.
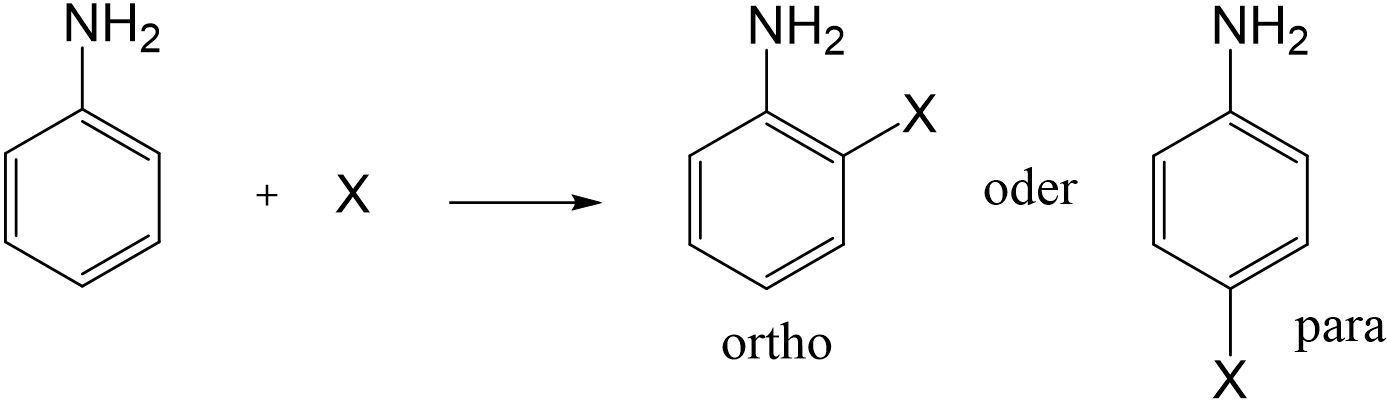
Elektrophile aromatische Zweitsubstitution – Beispiel Anilin
Da es sich bei Anilin um eine aromatische Verbindung mit einer Aminogruppe als Substituent handelt, kann diese Verbindung in einer elektrophilen aromatischen Zweitsubstitution reagieren. Betrachtet man die Effekte der Aminogruppe, so stellt man fest, dass sie einen -I-Effekt und einen +M-Effekt besitzt. Da mesomere Effekte stärker wirken als induktive Effekte, wird die Position des Zweitsubstituenten durch den elektronenschiebenden +M-Effekt bestimmt. Die Zweitsubstituenten werden also in ortho- bzw. para-Stellung gebunden.
Neu!