Protein
Proteine haben je nach Struktur unterschiedliche Eigenschaften und Funktionen. In jedem Lebewesen kommen daher viele verschiedene Proteine vor. In der Haut sind beispielsweise Proteine, welche eine Schutzfunktion besitzen. Sie sorgen dafür, dass der Körper vor äußeren Umwelteinflüssen geschützt ist. Die Proteine in den Muskeln hingegen sind für Bewegungen verantwortlich. Die beiden Proteine Myosin und Actin können unter Energieverbrauch gegeneinander bewegt werden, wodurch der Muskel verkürzt wird.
Auch in unserem Immunsystem spielen Proteine eine wichtige Rolle: Die Antikörper, welche Bakterien binden, und damit dafür sorgen, dass sie dem Körper nicht schaden können, sind ebenfalls Proteine.
Themen zum Protein auf dieser Seite
Proteine Grundlagen
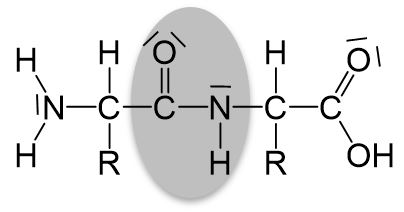
Ein Protein (umgangssprachlich auch Eiweiße genannt) ist ein biologisches Makromolekül, welches durch die Verknüpfung von Aminosäuren entsteht. Die bei dieser Verknüpfung entstehende Bindung heißt Peptidbindung. Sie entsteht durch eine Kondensationsreaktion zwischen der Aminogruppe einer und der Carboxygruppe einer anderen Aminosäure.
Proteine entstehen also durch eine Polykondensation mit sehr vielen Aminosäuren.
Die Peptidbindung ist planar (=liegt in einer Ebene) und kann trotz der Einfachbindung zwischen dem Kohlenstoffatom und dem Stickstoffatom nicht frei gedreht werden. Das liegt daran, dass es für die Peptidbindung folgende mesomere Grenzstrukturen gibt:
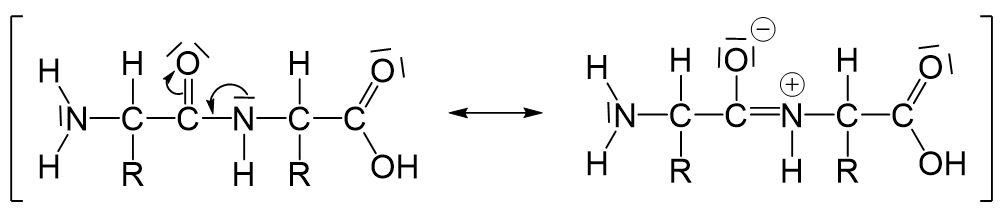
Durch die rechte Grenzstruktur wird klar, warum die Peptidbindung planar ist und keine freie Drehbarkeit vorliegt. Die nun entstandene Doppelbindung zwischen dem Kohlenstoffatom und dem Stickstoffatom ist der Grund dafür.
Schau dir als Vertiefung das Grundlagenvideo von Die Merkhilfe zum Thema Proteine an!
Protein Struktrebenen
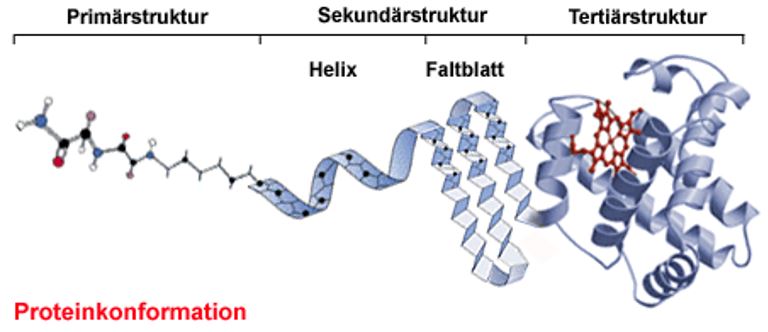
Primärstruktur von Proteinen
Die Primärstruktur von Proteinen stellt die Reihenfolge dar in der die Aminosäuren im Protein gebunden sind (auch Aminosäuresequenz genannt) an. Diese Reihenfolge ist wichtig, da Proteine nur dann ihre Wirkung zeigen können, wenn eine bestimmte Reihenfolge eingehalten wird. Sobald eine einzige Aminosäure ausgetauscht ist, wird die Funktion des Proteins beeinträchtigt oder zerstört.
Die Primärstruktur wird mit Hilfe der Abkürzungen der Aminosäuren angegeben (diese findest du in der Übersicht der Aminosäuren). Das Protein Insulin beispielsweise hat folgende Primärstruktur:
Phe – Val – Asn – Gln – His – Leu – Cys – Glu – Ser – His – Leu – Val – Glu – Ala – Leu – Tyr – Leu – Val – Cys – Glu – Glu – Arg – Gly – Phe – Phe – Tyr – Thr – Pro – Lys – Thr
Sekundärstruktur von Proteinen
Die Sekundärstruktur von Proteinen ist die räumliche Struktur, welche durch Wasserstoffbrückenbindungen zwischen den Peptidbindungen entsteht. Dabei wechselwirken das Wasserstoffatom einer Peptidbindung mit einem freien Elektronenpaar des Sauerstoffatoms in einer zweiten Peptidbindung.
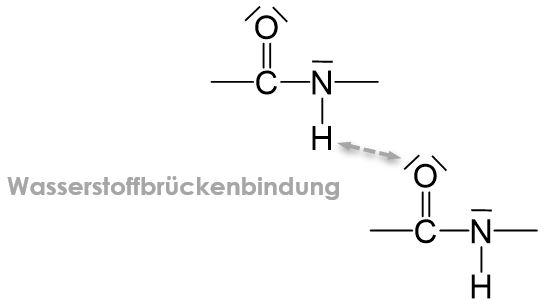
Bei der Sekundärstruktur wird zwischen zwei Arten unterschieden: die β-Faltblattstruktur und die α-Helixstruktur.
Bei der β-Faltblattstruktur liegen zwei Bereiche des Proteins parallel zueinander. Die Peptidbindungen sind planar. Zwischen ihnen liegen Kohlenstoffatome, an denen die Substituenten tetraedrisch angeordnet sind. Dadurch entsteht eine Struktur, die wie ein mehrfach gefaltetes Blatt Papier aussieht. Die organischen Reste sind abwechselnd über bzw. unter der Papierebene angeordnet.
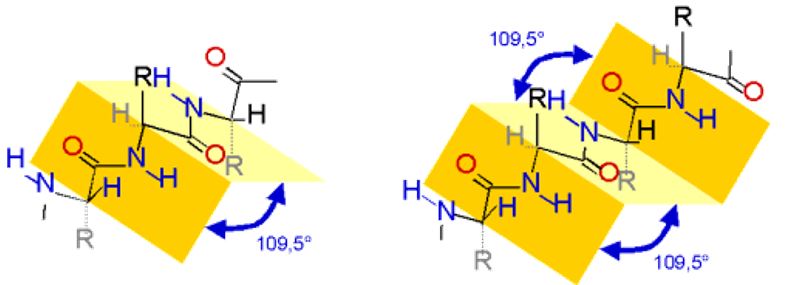
Die α-Helixstruktur entsteht ebenfalls durch Wasserstoffbrückenbindungen zwischen Peptidbindungen. Allerdings werden diese hier zwischen einer Peptidbindung und der drittnächsten ausgebildet. Dadurch entsteht eine Helix bei der die organischen Reste nach außen gerichtet sind.
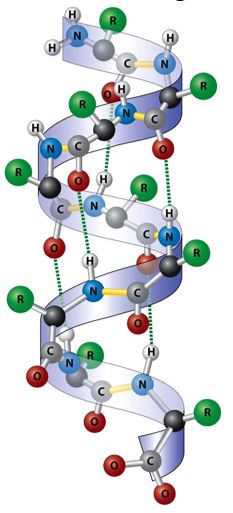
Tertiärstruktur von Proteinen
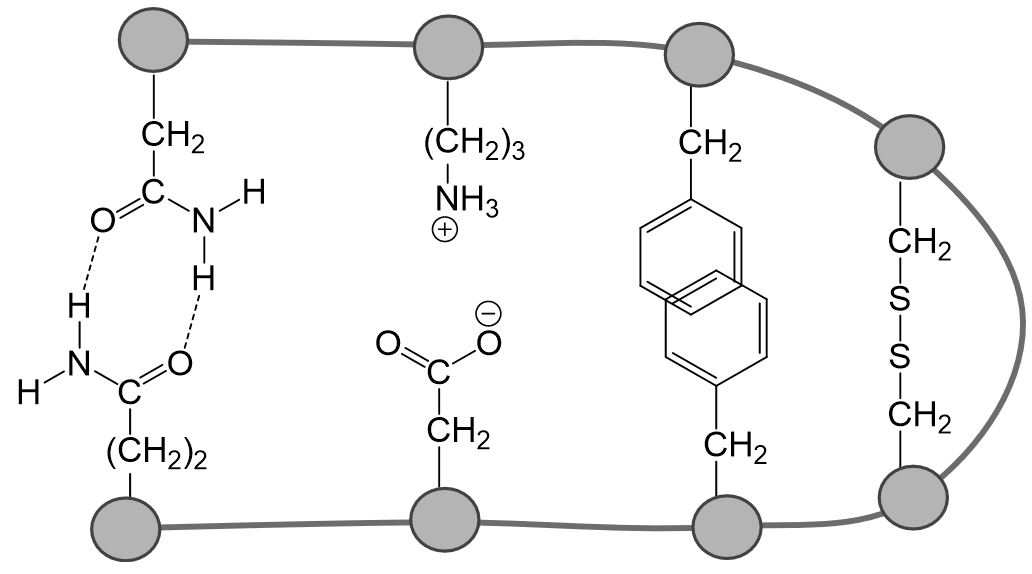
Die Tertiärstruktur beschreibt die räumliche Struktur eines Proteins, welche durch zwischenmolekularen Wechselwirkungen zwischen den organischen Resten der Aminosäuren entstehen. Es können van-der-Waals-Wechselwirkungen, Ionenbindungen, Wasserstoffbrückenbindungen oder Disulfidbrücken (Atombindungen zwischen den Schwefelatomen der Cystein-Reste) ausgebildet werden. Dadurch entstehen zusätzlich zu den Sekundärstrukturen weitere Verwindungen. Die Tertiärstruktur ist wichtig für die Funktionsfähigkeit des Proteins.
Die Tertiärstruktur ist eine Verknüpfung der Teile des Proteins, welche in einer bestimmten Sekundärstruktur ausgebildet sind.
In der folgenden Abbildung sind Beispiele für die verschiedenen Wechselwirkungen, die zu einer Tertiärstruktur führen, dargestellt.
Neu!
Quartärstruktur von Proteinen
Unter einer Quartärstruktur versteht man den Zusammenschluss von mehreren Proteinmolekülen durch zwischenmolekulare Wechselwirkungen und Disulfidbrücken. Dadurch entstehen räumliche Strukturen, die bestimmte Funktionen ermöglichen. In der folgenden Abbildung ist eine Quartärstruktur dargestellt, die durch den Zusammenschluss von vier verschiedenen Proteinen (hier farbig unterschieden) entsteht:
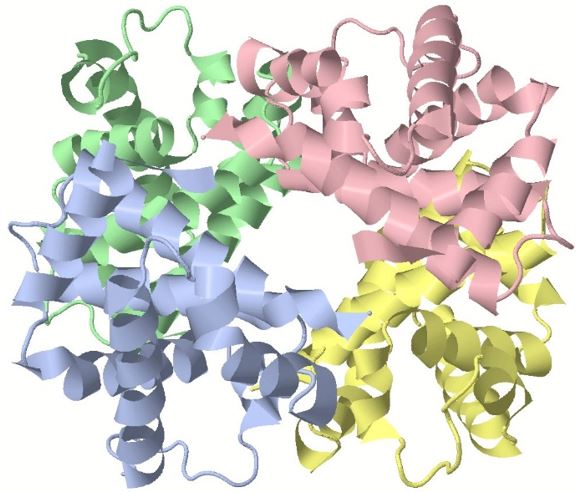
Nachweisreaktionen
Ninhydrin-Reaktion
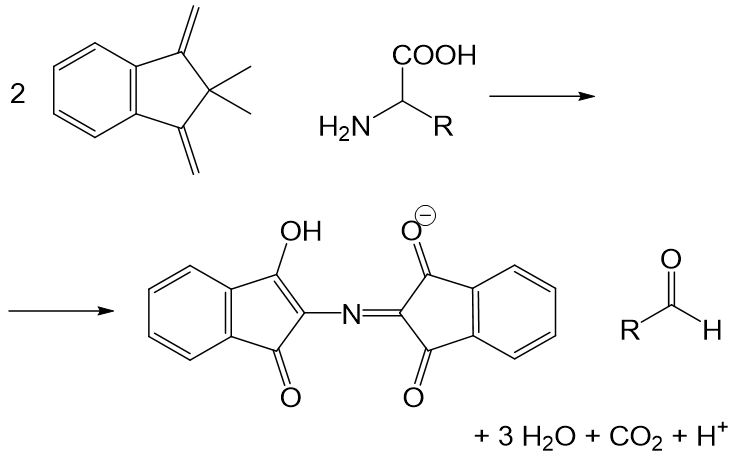
Eine mögliche Nachweisreaktion für Proteine und Aminosäuren ist die sogenannte Ninhydrin-Reaktion. Dabei wird eine Probelösung mit Ninhydrin versetzt. Ist ein Protein in der Lösung, so färbt sie sich blauviolett. Eines von zwei an der Reaktion beteiligten Ninhydrinmolekülen greift an der endständigen Aminogruppe an. Es entstehen ein blau-violetter Farbstoff, ein Aldehyd, Wasser und Kohlenstoffdioxid.
Xanthoprotein-Reaktion
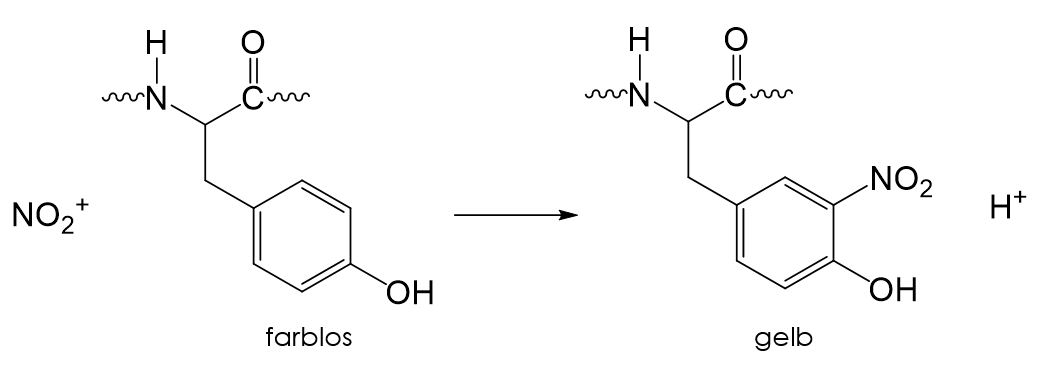
Eine weitere Nachweisreaktion für Proteine ist die sogenannte Xanthoprotein-Reaktion. Dabei wird eine Probe mit konzentrierter Salpetersäure (HNO_3) versetzt. Ist ein Protein in der Probe enthalten, so färbt sie sich gelb. Bei dieser Reaktion werden die aromatischen Reste der Aminosäuren Tyrosin, Tryptophan und Phenylalanin nitriert. Durch die Nitrogruppen wird das delokalisierte π-Elektronensystem vergrößert und es wird weniger Energie benötigt um das Molekül anzuregen. Dadurch wird die Absorption in den Bereich des sichtbaren Lichts verschoben und das Molekül erscheint farbig.
Neu!