Aufstellen von Strukturformeln
Strukturformeln sind in der Chemie von maßgeblicher Relevanz. Um die Strukturformel eines Moleküls aufzustellen, müssen wir folgende Schritte durcharbeiten:
Schritt 1: Valenzelektronen aller Atome in der Verbindung zusammenzählen
Schritt 2: Anzahl der Elektronenpaare berechnen: Anzahl aller Valenzelektronen durch zwei dividieren
Schritt 3: 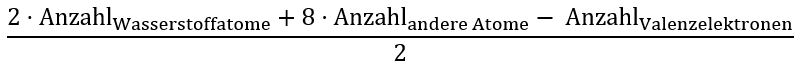
Schritt 4: Verteilen der bindenden und freien Elektronenpaare. Wichtig: Wir müssen darauf achten, dass Wasserstoffatomen immer genau zwei Elektronen zugeordnet werden, allen anderen Atomen acht Elektronen
Schritt 5: Ermitteln von Ladungen innerhalb des Moleküls
- Valenzelektronen aller Atome in der Verbindung zusammenzählen
Ein Sauerstoffatom hat sechs Valenzelektronen, da es in der sechsten Hauptgruppe steht. Ein Wasserstoffatom hat ein Valenzelektron, da es in der ersten Hauptgruppe steht. Wichtig: Es sind zwei Wasserstoffatome in einem Wassermolekül gebunden! Für H2O stellen wir also die Formel 1*2+6=8 auf. Insgesamt sind also 8 Valenzelektronen im Wassermolekül enthalten. - Anzahl der Elektronenpaare berechnen
Die in Schritt eins ermittelten Valenzelektronen werden nun durch zwei dividiert um die Anzahl der Elektronenpaare zu kennen. Aus der Berechnung geht hervor, dass 4 Elektronenpaare vorhanden sind. - Bindende Elektronenpaare berechnen
Um herauszufinden, wie viele der Elektronenpaare in einem Molekül bindend sind, verwenden wir die oben aufgeführte Formel und erhalten (2*2+8*1-8)/2=2. Es sind also 2 bindende Elektronenpaare vorhanden. - Verteilen der bindenden- und freien Elektronenpaare.
Zunächst schreiben wir uns alle Atome auf und verteilen die bindenden EP. In diesem Fall gibt es nur eine Möglichkeit.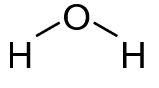 Nun zählen wir wie viele Elektronen jeweils fehlen. Die Wasserstoffatome besitzen mit der einen Bindung bereits je zwei Elektronen – hier sind wir also fertig.
Nun zählen wir wie viele Elektronen jeweils fehlen. Die Wasserstoffatome besitzen mit der einen Bindung bereits je zwei Elektronen – hier sind wir also fertig.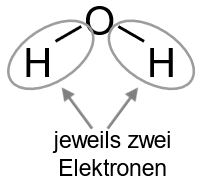 Das Sauerstoffatom hat bisher mit den beiden Bindungen nur vier Elektronen, es fehlen also nochmal vier. Daher teilen wir die beiden freien Elektronenpaare dem Sauerstoff zu.
Das Sauerstoffatom hat bisher mit den beiden Bindungen nur vier Elektronen, es fehlen also nochmal vier. Daher teilen wir die beiden freien Elektronenpaare dem Sauerstoff zu.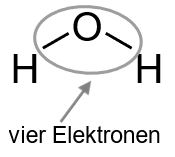
Neu!
Daraus ergibt sich folgende Strukturformel (ohne Prüfen auf Ladungen):
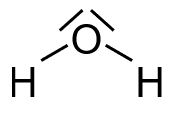
- Ermitteln von Ladungen innerhalb des Moleküls
- Für das Ermitteln der Ladungen werden die Elektronenpaare aufgeteilt.
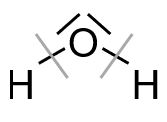 Wir zählen die Elektronen, die nach dieser Aufteilung den einzelnen Atomen zugeordnet sind. Bei den Wasserstoffatomen ist es jeweils ein Elektron. Da Wasserstoff auch ein Valenzelektron besitzt, stimmt die Anzahl der Valenzelektronen mit der Anzahl der im Molekül zugeordneten Elektronen überein und das Wasserstoffatom hat keine Ladung.
Wir zählen die Elektronen, die nach dieser Aufteilung den einzelnen Atomen zugeordnet sind. Bei den Wasserstoffatomen ist es jeweils ein Elektron. Da Wasserstoff auch ein Valenzelektron besitzt, stimmt die Anzahl der Valenzelektronen mit der Anzahl der im Molekül zugeordneten Elektronen überein und das Wasserstoffatom hat keine Ladung.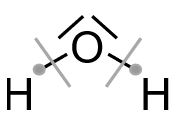 Dem Sauerstoffatom sind sechs Elektronen zugeordnet. Auch hier liegt keine Ladung vor, da diese Zahl mit der Anzahl der Valenzelektronen von Sauerstoff übereinstimmt.
Dem Sauerstoffatom sind sechs Elektronen zugeordnet. Auch hier liegt keine Ladung vor, da diese Zahl mit der Anzahl der Valenzelektronen von Sauerstoff übereinstimmt. 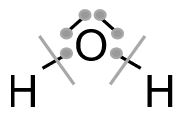
- Valenzelektronen aller Atome in der Verbindung zusammenzählen
Schwefel und Sauerstoff stehen jeweils in der sechsten Haupt-gruppe, sodass jedes dieser Atome sechs Valenzelektronen hat.Wichtig: Es sind zwei Sauerstoffatome in dem Molekül gebunden! Zur Berechnung der Valenzelektronen setzen wir wieder in die oben gezeigte Formel ein und erhalten: 6+6*2=18 - Anzahl der Elektronenpaare berechnen
Um die Anzahl der Elektronenpaare zu ermitteln, müssen wir die im ersten Schritt ermittelten Valenzelektronen durch zwei dividieren und erhalten 18 : 2 = 9 Elektronenpaare. - Bindende Elektronenpaare berechnen
Nun verwenden wir die oben aufgeführte Formel. Es sind keine Wasserstoffatome, lediglich drei andere Atome in dem Molekül gebunden. Wir berechnen wieder: (2⋅0+8⋅3-18)/2=3. Es sind also 3 bindende Elektronenpaare und 6 freie Elektronenpaare vorhanden. - Verteilen der bindenden und freien Elektronenpaare
Wir nehmen alle Atome und verteilen die bindenden EP. Um das gewählte Zentralatom (i.d.R. das Atom, welches einmal vorkommt) verteilen wir die anderen Atme außen herum.
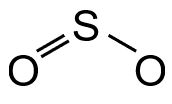
Neu!
Nun zählen wir erneut wie viele Elektronen jeweils fehlen. Da das linke Sauerstoffatom vier Elektronen besitzt, fehlen noch vier weitere (zwei EP).
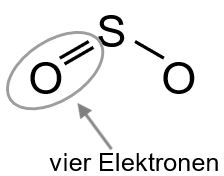 Das Schwefelatom hat sechs Elektronen, es fehlen also noch zwei (ein EP).
Das Schwefelatom hat sechs Elektronen, es fehlen also noch zwei (ein EP).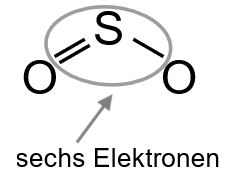
Das rechte Sauerstoffatom hat zwei Elektronen, es fehlen noch sechs (drei EP).
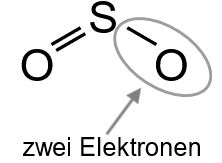
Daraus ergibt sich folgende Strukturformel (ohne Prüfen auf Ladungen):
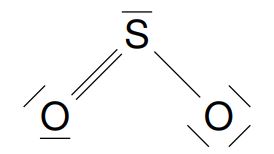
- Ermitteln von Ladungen innerhalb des Moleküls
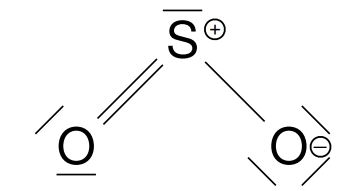
Für das Ermitteln der Ladungen teilen wir die Elektronenpaare nochmals auf. Wir zählen die Elektronen, die nach dieser Aufteilung den einzelnen Atomen zugeordnet sind. Dem linken Sauerstoffatom sind sechs Elektronen zugeordnet. Da es ebenfalls sechs Valenzelektronen besitzt, ergibt sich hier keine Ladung.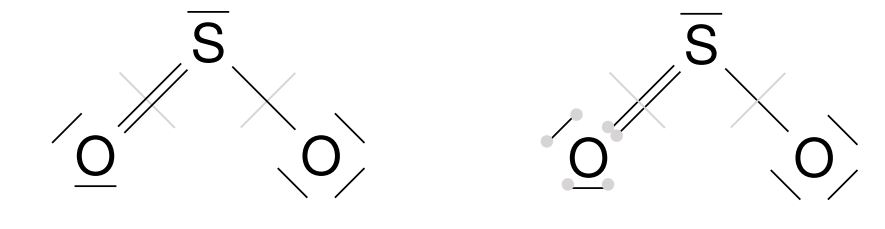 Dem Schwefelatom sind fünf Elektronen zugeordnet. Da Schwefel mit sechs Valenzelektronen versehen ist, ist ein Elektron weniger zugeordnet, was bedeutet, dass hier eine einfach-positive Ladung entsteht.
Dem Schwefelatom sind fünf Elektronen zugeordnet. Da Schwefel mit sechs Valenzelektronen versehen ist, ist ein Elektron weniger zugeordnet, was bedeutet, dass hier eine einfach-positive Ladung entsteht.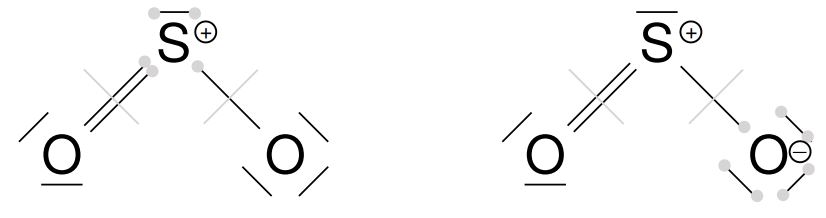 Dem rechten Sauerstoffatom sind sieben Elektronen zugeordnet, aber Sauerstoff hat sechs Valenzelektronen. Es liegt also eine negative Ladung mehr als gewöhnlich vor, weshalb eine einfach-negative Ladung entsteht.
Dem rechten Sauerstoffatom sind sieben Elektronen zugeordnet, aber Sauerstoff hat sechs Valenzelektronen. Es liegt also eine negative Ladung mehr als gewöhnlich vor, weshalb eine einfach-negative Ladung entsteht.
Daraus ergibt sich insgesamt folgende Strukturformel:
Neu!