Bindungstypen
Bei Reinstoffen gibt es verschiedene Arten, wie die einzelnen Atome miteinander verknüpft sein können. Dabei unterscheiden wir zwischen den drei Bindungstypen Metallbindung, Ionenbindung und Elektronenpaarbindung.
Themen auf dieser Seite
Schau dir zur Einführung in das Thema Bindungstypen unser Lernvideo an!
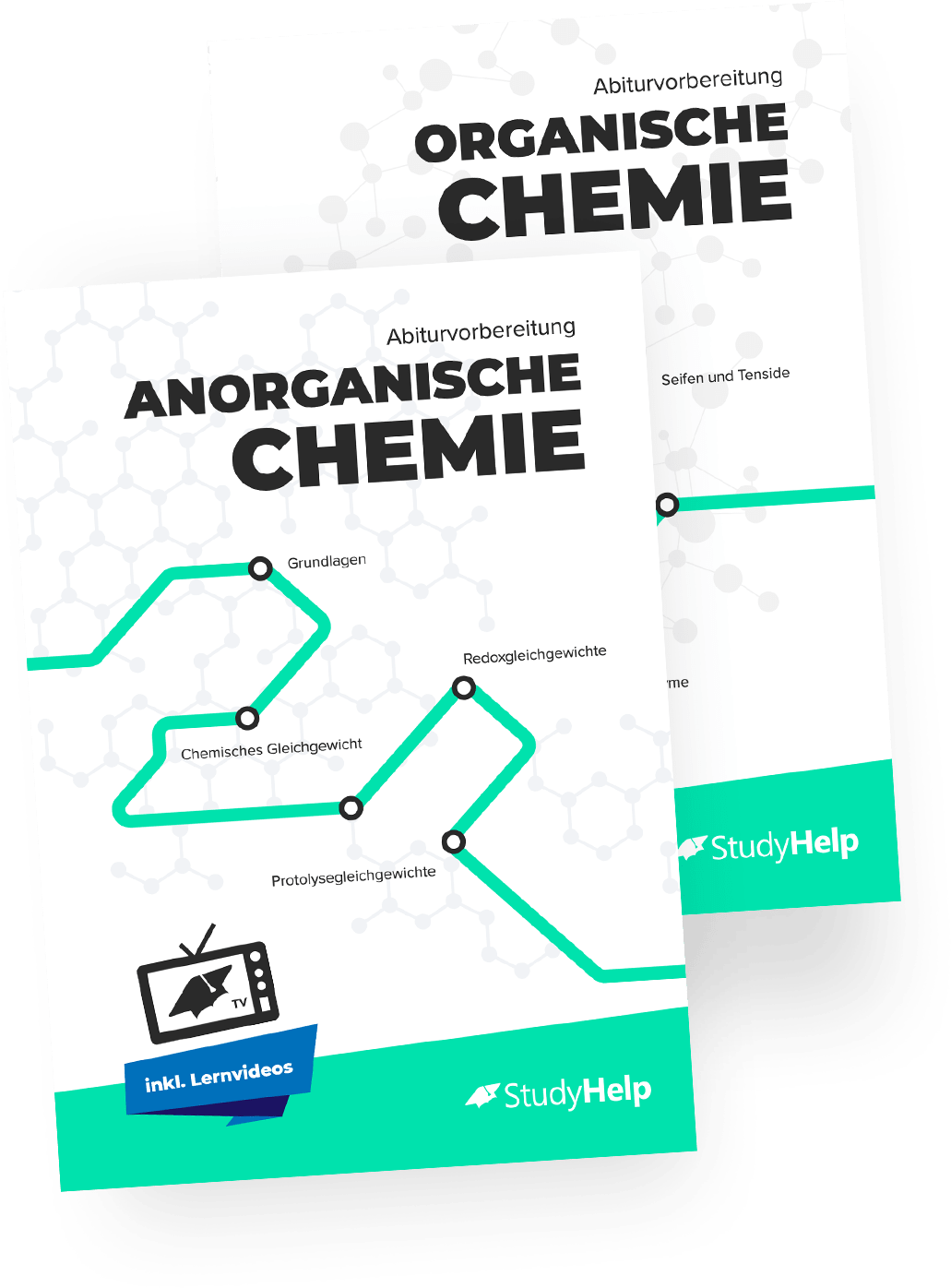
Die Metallbindung
Eine Metallbindung ist eine Verbindung zwischen Metallatomen. Alle Metallatome geben ihre Valenzelektronen ab, welche sich frei beweglich als Elektronengas zwischen den positiv geladenen Atomrümpfen befinden. Diese Art der Bindung erklärt die plastische Verformbarkeit der Metalle.
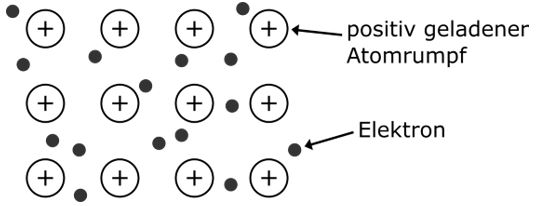
Die Ionenbindung
Eine Ionenbindung ist eine Verbindung aus Metall- und Nichtmetallatomen. Dabei gibt das Metallatom Elektronen ab (Metall wird zum Kation), welche vom Nichtmetallatom aufgenommen werden (Nichtmetall wird zum Anion). Da die entstandenen Ionen unterschiedlich geladen sind (Kation positiv geladen, Anion negativ geladen), ziehen sie sich gegenseitig an. Es entsteht ein sogenanntes Ionengitter (oder Salzgitter).
Beispiel: Natriumchlorid
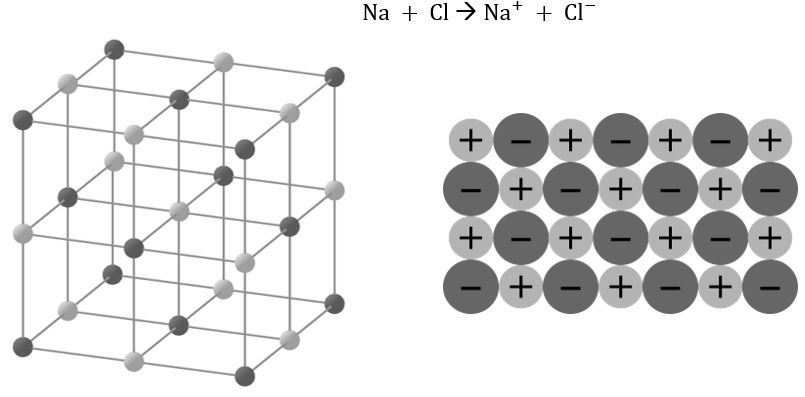
Die Elektronenpaarbindung
Elektronenpaarbindungen sind Verbindungen zwischen Nichtmetallatomen. Atome teilen sich hier ein Elektronenpaar. Diese Elektronenpaare, welche Atome zusammenhalten, heißen bindende Elektronenpaare. Demgegenüber stehen nichtbindende Elektronenpaare. Wichtig: Elektronenpaare werden in Strukturformeln als Striche geschrieben.
Neu!