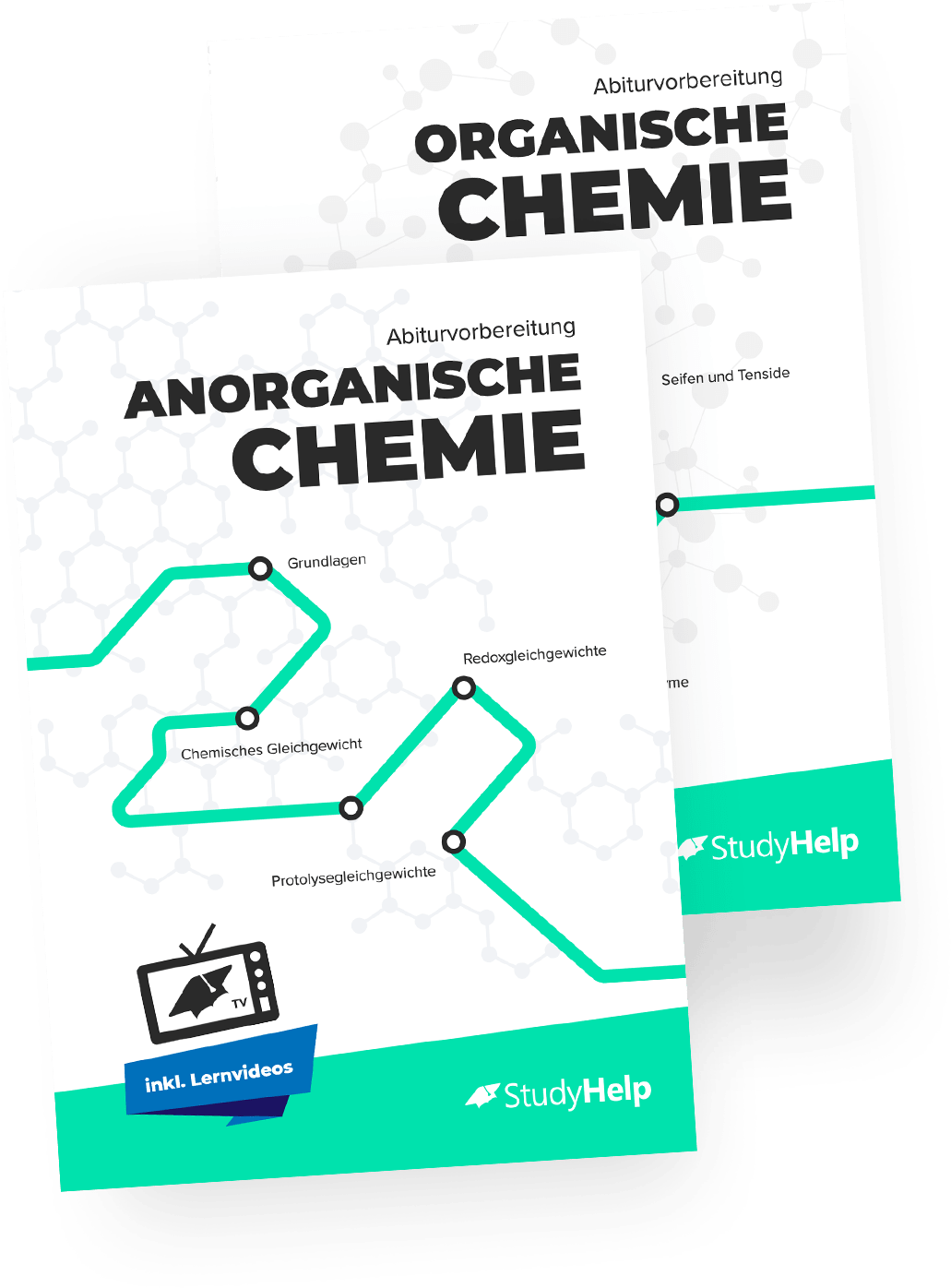
Carbonsäure
Bei Carbonsäure handelt es sich um eine organische Säure, die eine funktionelle Carboxygruppe enthält. Diese Gruppe setzt sich aus einer Carbonyl- und einer Hydroxygruppe zusammen. Die Strukturformel für Carbonsäure sieht wie folgt aus:
Themen zu Carbonsäure auf dieser Seite
- Schmelz- und Siedepunkte von Carbonsäure
- Löslichkeit von Carbonsäure
- Acidität (Einfluss der Substituenten)
- Reaktionsverhalten von Carbonsäuren
Schmelz- und Siedepunkte von Carbonsäure
Bei Carbonsäuren gibt es, wie bei allen Molekülen, van-der-Waals-Wechselwirkungen. Die Stärke dieser Wechselwirkungen wird von den selben Einflüssen bestimmt, die wir bereits bei den Kohlenwasserstoffen bestimmt haben.
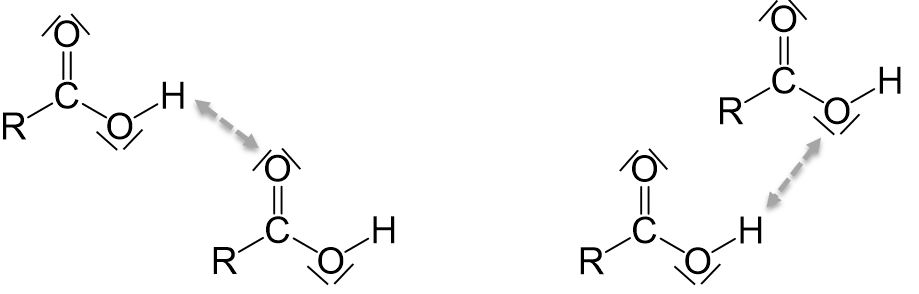
Zusätzlich können Carbonsäuren, wie auch Alkohole, Wasserstoffbrückenbindungen ausbilden. Die Wasserstoffbrückenbindungen sind bei Carbonsäuren allerdings höher als bei Alkoholen der gleichen Kettenlänge, da sowohl die freien Elektronenpaare des Sauerstoffatoms der Carbonylgruppe als auch die freien Elektronenpaare des Sauerstoffatoms der Hydroxygruppe mit einem positiv polarisierten Wasserstoffatom wechselwirken können. Daher sind Schmelz- und Siedepunkt von Carbonsäuren höher als die der entsprechenden Alkohole.
Neu!
Löslichkeit von Carbonsäure
Die Löslichkeit von Carbonsäuren ist, analog zu den Aldehyden, abhängig von der Länge des unpolaren organischen Rests.
Acidität (Einfluss der Substituenten)
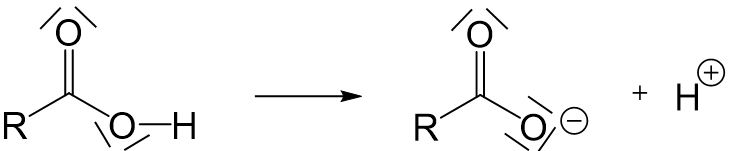
Bei Carbonsäuren handelt es sich um Brönstedtsäuren – also Protonendonatoren. Die Carboxygruppe kann ein Proton abgeben, wobei ein Carboxylation entsteht.
Doch warum wird dieses Proton, im Gegensatz zu dem Proton der Hydroxygruppe der Alkohole, so leicht abgegeben?
Für das entstehende Carboxylation gibt es eine mesomere Grenzstruktur mehr als für die entsprechende Carbonsäure, weshalb das deprotonierte Molekül stabiler ist.
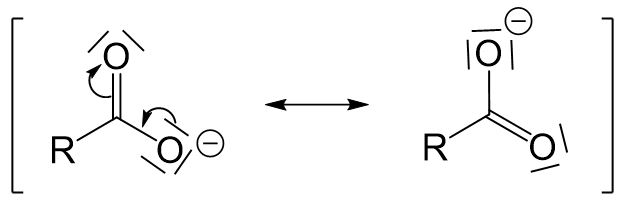
Die Stärke der Carbonsäure (umgangssprachlich: wie leicht das Proton abgegeben werden kann) hängt von dem Test an der Carboxygruppe ab. Für diesen Test vergleichen wir drei verschiedene Carbonsäuren:
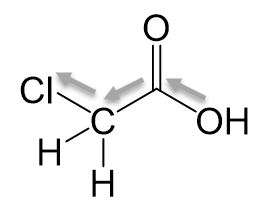
Monochlorethansäure
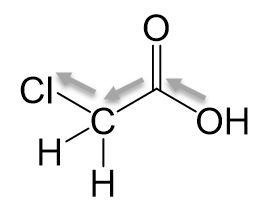 Wir sehen einen Induktiven-Effekt, wodurch Elektronen aus der Carboxygruppe gezogen werden. Die Elektronendichte ist niedriger, wodurch das Sauerstoffatom der Hydroxygruppe seine Elektronen weniger gern teilt. Daraus resultieren wird das Proton leichter abgespalten, da das bindende Elektronenpaar nicht mehr geteilt werden muss.
Wir sehen einen Induktiven-Effekt, wodurch Elektronen aus der Carboxygruppe gezogen werden. Die Elektronendichte ist niedriger, wodurch das Sauerstoffatom der Hydroxygruppe seine Elektronen weniger gern teilt. Daraus resultieren wird das Proton leichter abgespalten, da das bindende Elektronenpaar nicht mehr geteilt werden muss.
Neu!
Methansäure
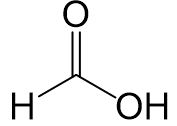
Der Rest (das Wasserstoffatom) hat keinen Effekt.
Ethansäure
Der Rest hier hat einen +I-Effekt, wodurch Elektronen in die Carboxygruppe geschoben werden. Die Elektronendichte ist höher, wodurch das Sauerstoffatom der Hydroxygruppe seine Elektronen bereitwilliger teilt. Daraus folgt, dass das Proton nicht unbedingt abgespalten werden muss.
Allgemein lässt sich folgende Regel aufstellen: Ein Rest mit -I-Effekt erhöht die Acidität einer Carbonsäure. Ein Rest mit +I-Effekt verringert die Acidität. Je stärker der -I-Effekt ist, desto höher ist die Acidität. Je stärker der +I-Effekt ist, desto niedriger ist die Acidität.
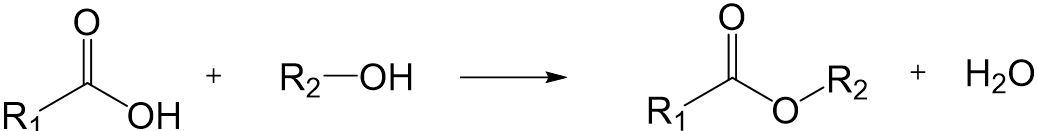
Reaktionsverhalten von Carbonsäuren
Carbonsäuren können mit Alkoholen unter einer Kondensationsreaktion zu Estern reagieren. Diese Reaktion heißt auch Veresterung.
Neu!