
Nucleophile Substitution
Die Nucleophile Substitution ist eine Substitutionsreaktion, bei der ein Nucleophil an ein Molekül gebunden wird. Damit diese Bindung eingegangen werden kann, muss ein anderes Teilchen aus dem Molekül austreten. Bei der Nucleophile Substitution ist das austretende Teilchen ein kleines stabiles Molekül wie z.B. Wasser.
Um die Nucleophile Substitution besser verstehen zu können, haben wir für euch ein Beispiel aufbereitet: wir betrachten die Reaktion von Carbonsäure (Elektronenpaardonor) und einem Alkohol (Elektronenpaarakzeptor).
Beispiel Nucleophile Substitution
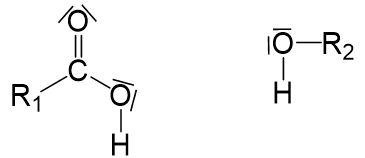
Zu Beginn der Nucleophilen Substitution betrachten wir die Carbonsäure- und Alkoholmoleküle genauer, um positivierte- Atome oder Ladungen zu finden.
Bei der Carbonsäure kann man durch mesomere Grenzstrukturen eine positive Ladung erzeugen.
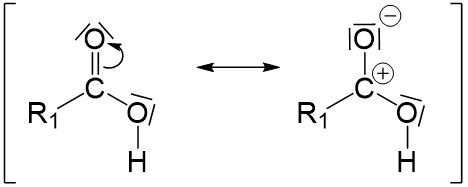
Die entstandene positive Ladung in der Carbonsäure muss durch ein angreifendes Elektronenpar wieder ausgeglichen werden. An dieser Stelle fügen wir das Alkoholmolekül hinzu. Wir nutzen ein freies Elektronenpaar des Alkohols um die positive Ladung auszugleichen.
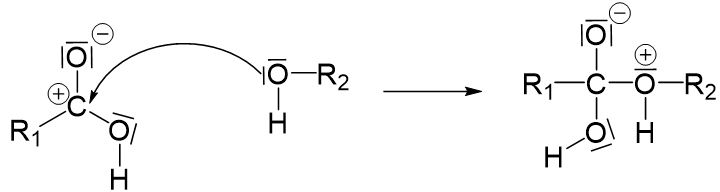
Nach diesem ersten Reaktionsschritt muss ebenfalls überprüft werden, ob Ladungen entstanden sind.
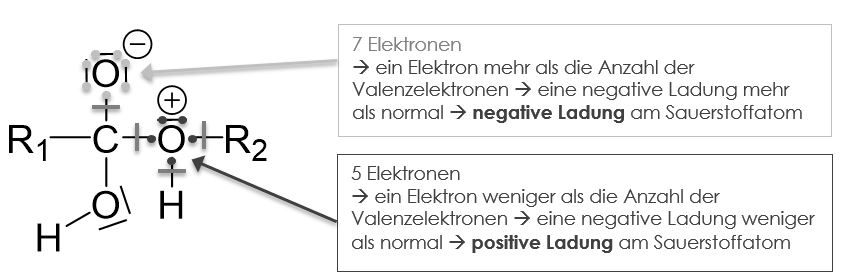
Die entstandene positive Ladung können wir dieses Mal ebenfalls nicht durch ein Elektronenpaar ausgleichen, da das Sauerstoffatom bereits die maximale Anzahl an Elektronen besitzt und daher keinen freie Platz auf der Valenzschale zu vergeben hat.
Die positive Ladung kann nur ausgleichen werden, indem eines der bindenden Elektronenpaare nicht mehr geteilt wird. Es muss sich die Frage gestellt werden,welche der Bindungen am leichtesten zu trennen ist. Wie schon im Beispiel bei der Nucleophilen Addition kann die O-H-Bindung am leichtesten getrennt werden, da hier die Elektronegativitätsdifferenz am größten ist. Es wird ein Proton (H^+) abgespalten, welches durch eine intramolekulare Protonenwanderung innerhalb des Moleküls umgelagert wird.
Doch wohin wandert das Proton? Da es positiv geladen ist, könnte es zu der negativen Ladung am oberen Sauerstoffatom wandern.
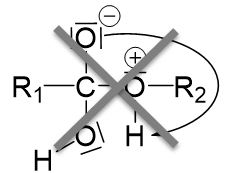
Hier kommt ein wichtiges Prinzip der organischen Chemie ins Spiel: Sobald durch eine intramolekulare Protonenwanderung im Bereich des Reaktionsgeschehens Wasser abgespalten werden kann, passiert dies auch.
Folglich wird das Proton durch ein freies Elektronenpaar des Sauerstoffatoms in der Alkoholgruppe aufgenommen.
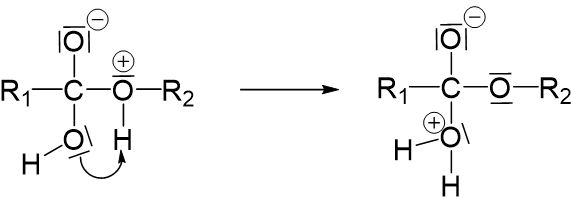
Die entstandene positive Ladung am Sauerstoffatom muss ausgeglichen werden, was wieder nur passiert, wenn ein bindendes Elektronenpaar nicht mehr geteilt wird.
Hierfür wird die Einfachbindung zwischen dem Kohlenstoffatom und dem Sauerstoffatom getrennt, da dies zur Folge hat, dass Wasser abgespalten wird.
Würde die Einfachbindung zwischen einem Wasserstoffatom und dem Sauerstoffatom getrennt werden, würden wir den vorherigen Reaktionsschritt wieder rückgängig machen.
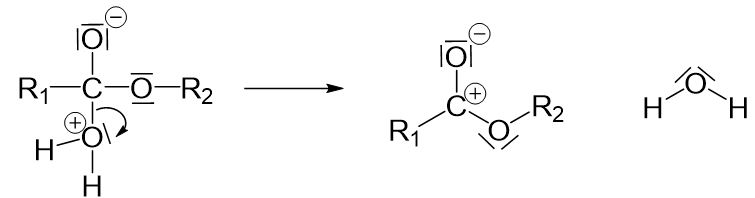
Jetzt ist eine positive Ladung am Kohlenstoffatom entstanden, welche ausgeglichen werden muss. Wir bilden die mesomere Grenzstruktur und „klappen“ das freie Elektronenpaar des Sauerstoffatoms herein.
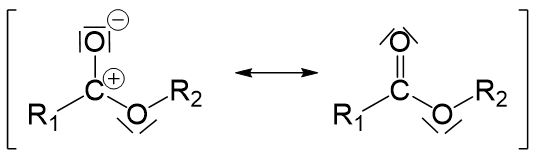
Wir sehen, dass keine positive Ladung mehr vorhanden ist und somit unsere Nucleophile Substitution abgeschlossen ist.
Auch hier schauen wir uns noch den Namen des Mechanismus an: „Nucleophile Substitution.“
- Substitution bedeutet, dass ein Teilchen an ein Molekül angebaut wurde und dass dafür ein anderes aus dem Molekül rausgeworfen werden musste.
- Das Teilchen, das angreift, ist hier ein Alkohol, welcher an einem positiv polarisierten Atom angreift und somit als Nucleophil reagiert.
- Bei dem Reaktionsprodukt handelt es sich um einen Ester, weshalb es sich bei dieser Nucleophilen Substitutaion um eine besondere handelt, nämlich die Veresterung. Die Rückreaktion wäre entsprechend die Verseifung.