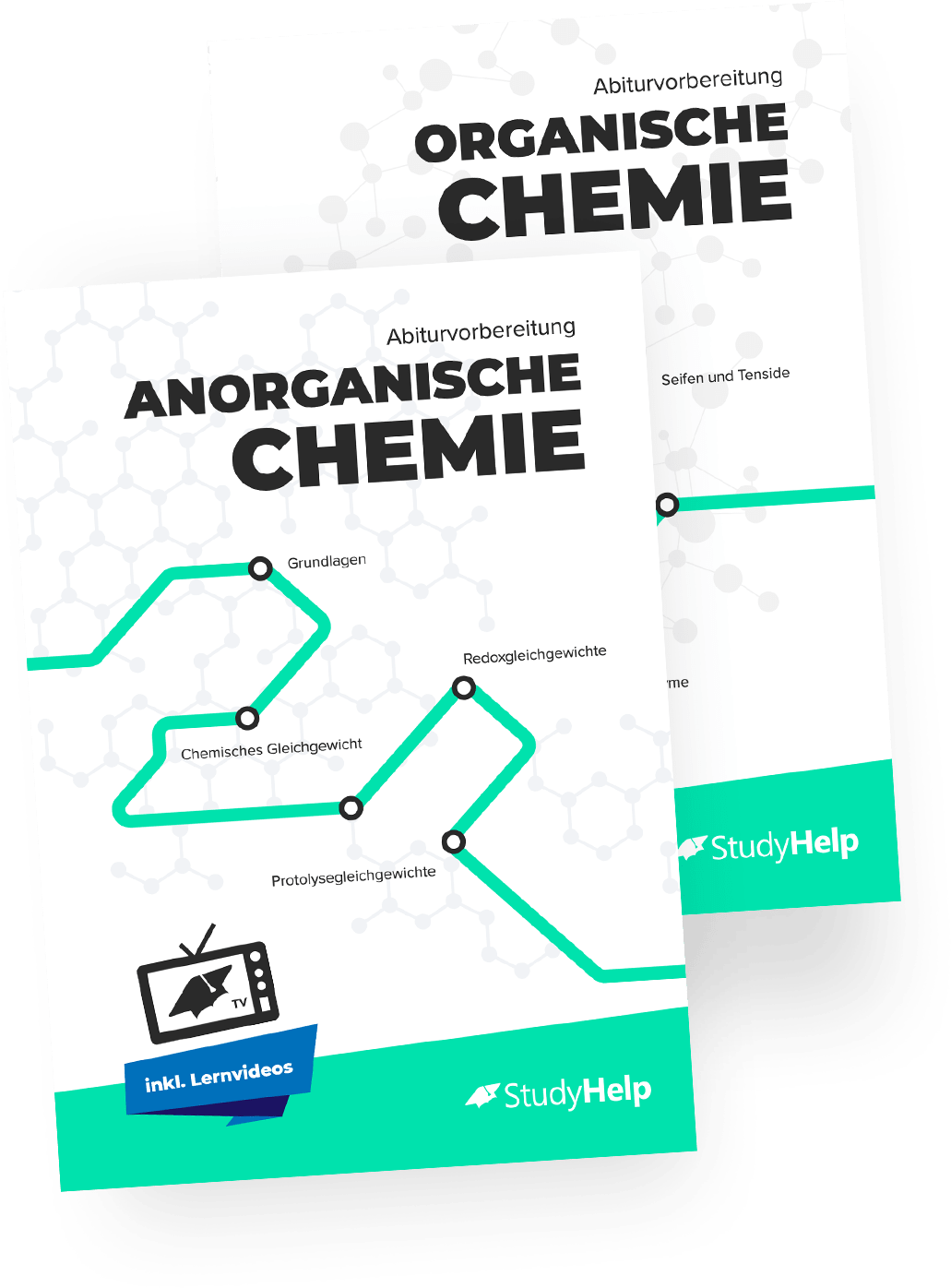
Phenole
Phenole sind aromatische Hydroxyverbindung, bei denen bis zu drei Hydroxygruppen an die Kohlenstoffatome des Benzolrings gebunden sein können.
Neu!
Acidität – Phenole als Säuren
Phenole sind im Vergleich zu Alkanolen die deutlich stärkeren Säuren. Doch woran liegt es, dass die Hydroxydgruppe der Phenole leichter ein Proton abgibt als die von Alkanolen?
Dazu betrachten wir die Struktur eines deprotonierten Phenols. Man stellt schnell fest, dass es hier mesomere Grenzstrukturen gibt (bei Alkanolaten ist dies nicht der Fall). Daher ist das Phenolat deutlich stabiler als Alkanolate.
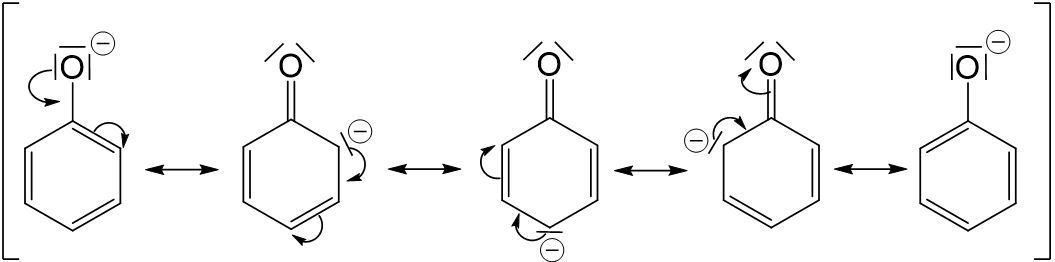
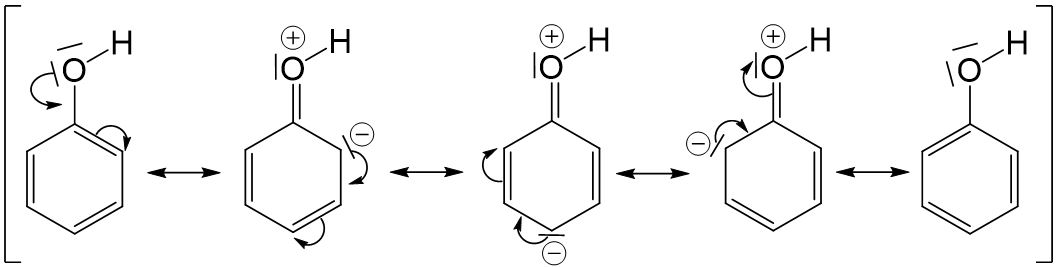
Vergleicht man die Grenzstrukturen des Phenolations mit denen des Phenols, so stellt man fest, dass gleich viele Grenzstrukturen formuliert werden können. Bei drei der vier Grenzstrukturen des Phenols entsteht eine positive Ladung am Sauerstoffatom, wodurch diese Grenzstrukturen deutlich instabiler sind als die des Phenolations. Da durch Deprotonierung also ein stabileres Molekül entsteht, läuft diese Reaktion sehr gut ab.
Elektrophile aromatische Zweitsubstitution
Da es sich bei Phenol um eine aromatische Verbindung mit einer Hydroxygruppe als Substituent handelt, kann diese Verbindung in einer elektrophilen aromatischen Zweitsubstitution reagieren. Betrachtet man die Effekte der Hydroxygruppe, so stellt man fest, dass sie einen -I-Effekt und einen +M-Effekt besitzt. Da mesomere Effekte stärker wirken als induktive Effekte, wird die Position des Zweitsubstituenten durch den elektronenschiebenden +M-Effekt bestimmt. Die Zweitsubstituenten werden also in ortho- bzw. para-Stellung gebunden.
Neu!