
Redoxreaktion
Bei einer Redoxreaktion handelt es sich um eine chemische Reaktion, bei der Elektronen von einem Reaktionspartner auf den anderen übergehen. Ähnlich wie bei den Protonenübergängen gibt es auch hier einen Elektronendonator und einen Elektronenakzeptor. Wichtig ist, dass Elektronen nur abgegeben werden können, wenn es ein Teilchen gibt, welches diese aufnehmen kann.
Eine Redoxreaktion besteht aus zwei Teilreaktionen:
- die Reduktion und
- die Oxidation.
Die Oxidation ist die Reaktion, bei der Elektronen abgegeben werden; die Reduktion ist die Reaktion, bei der Elektronen aufgenommen werden.
Weitere wichtige Begriffe in diesem Zusammenhang sind Oxidationsmittel und Reduktionsmittel. Ein Oxidationsmittel ist ein Teilchen, das einen anderen Stoff oxidiert, also Elektronen aufnimmt und selbst reduziert wird. Ein Reduktionsmittel ist ein Teilchen, das einen anderen Stoff reduziert, also Elektronen abgibt und selbst oxidiert wird.
Redoxreaktionen sind, wie die Protonenübergänge, umkehrbar und somit Gleichgewichtsreaktionen. Daher gibt es auch hier korrespondierende Redoxpaare.
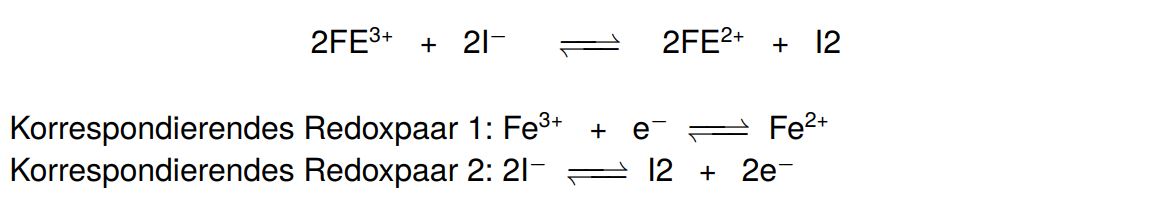
Redoxreaktionen gehören zu den wichtigsten Reaktionsarten in der Chemie. Im Folgenden wird das Aufstellen einer Redoxreaktion an einem Beispiel schrittweise erklärt.
- Bestimmen der Oxidationszahlen
- Bestimmen der Oxidation bzw. Reduktion
- Mengenausgleich der oxidierten bzw. reduzierten Teilchen
- Ausgleichen der Oxidationszahlen durch Elektronen (einfach negativ geladene Teilchen)
- Ausgleichen der echten Ladungen durch H3O+-Ionen im sauren Milieu bzw. OH−-Ionen im basischen Milieu
- Stoffausgleich mit H2O
- Zusammenschreiben zur Redox-Gleichung
Beispiel: Dichromat-Ionen reagieren mit Iodid-Ionen zu Iod und Chrom(III)-Ionen. Die Reaktion findet im sauren pH-Wert-Bereich statt.
Betrachten wir zunächst die Reaktion von Dichromat zu Chrom(III).
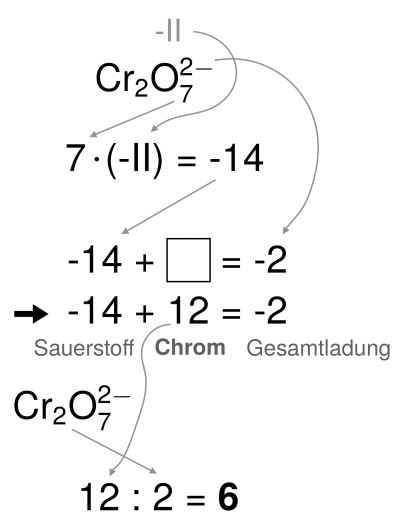
1. Bestimmen der Oxidationszahlen
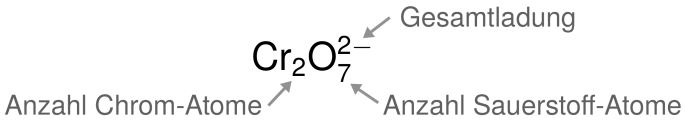
- Sauerstoff hat in Verbindungen immer die Oxidationszahl -II.
- Insgesamt sind in der Verbindung sieben Sauerstoff-Atome mit jeweils der Oxidationszahl -II.
- Alle Oxidationszahlen ergeben aufsummiert die Gesamtladung des Moleküls (hier -2).
- Alle Chrom-Atome haben zusammen die Oxidationszahl 12.
- Da zwei Chromatome in dem Molekül gebunden sind, teilen wir die Oxidationszahl noch auf.
Chrom-(III): Cr^3+
Auch hier müssen die Oxidationszahlen aufsummiert die Gesamtladung ergeben.
Es liegt hier nur ein Atom vor (und nicht wie bei Dichromat mehrere), weshalb die Ladung auch gleichzeitig die Oxidationszahl (+III) darstellt.
2. Bestimmen der Oxidation bzw. Reduktion
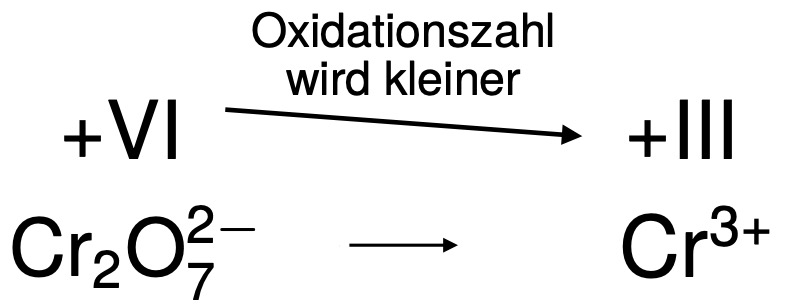
Von Dichromat zu Chrom-(III) ändert sich die Oxidationszahl von +VI auf +III, wird also reduziert. Wir sprechen hier von Reduktion.
3. Mengenausgleich der oxidierten bzw. reduzierten Teilchen
Auf beiden Seiten des Reaktionspfeils muss am Ende die gleiche Anzahl an Atomen jeder Sorte stehen (Massenerhaltung). Die Atomsorte, bei der sich die Oxidationszahl ändert, muss gleich zu Beginn ausgeglichen werden.
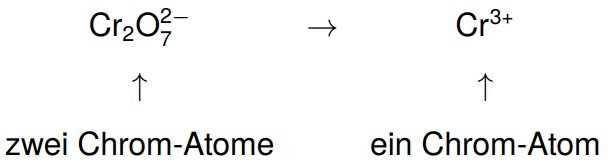
Da auf der linken Seite zwei Chrom-Atome stehen, benötigen wir auf der rechten Seite ebenfalls zwei und gleichen mithilfe eines Koeffizienten aus.
\begin{align*}
{Cr_2O_7^{2-}} \rightarrow {2 Cr^{3+}}
\end{align*}
4. Ausgleich der Oxidationszahl durch Elektronen
Die Oxidationszahlen müssen nun mithilfe von Elektronen (einfach negativ geladene Teilchen) ausgeglichen werden. Wir stellen uns das Ganze dazu wie eine mathematische Gleichung vor, die wir mit einer negativen Zahl so erweitern müssen, dass eine wahre Aussage entsteht.
Wir haben jeweils zwei Atome und verdoppeln daher auch die Oxidationszahlen.
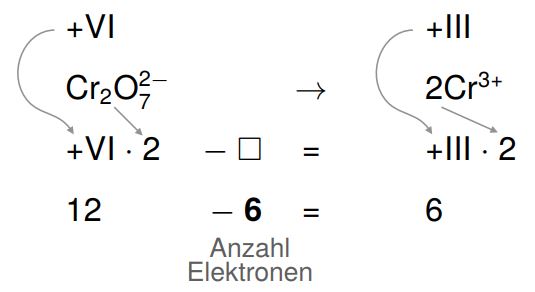
Indem wir die Gleichung auf der linken Seite um minus sechs erweitern, entsteht eine wahre Aussage: Auf der linken Seite werden sechs Elektronen benötigt.
5. Ausgleichen der echten Ladungen durch H3O^+ Ionen und OH^- Ionen
Nun werden die echten Ladungen ausgeglichen. Da die Reaktion im sauren stattfindet, gleichen wir mit H3O+ (einfach positiv geladene Teilchen) aus.
Wir stellen wieder den Vergleich zu einer mathematischen Gleichung her:
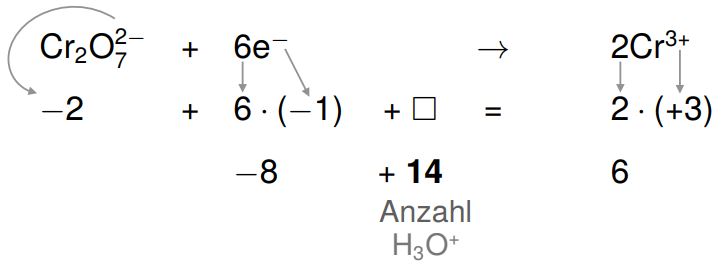
Indem wir die Gleichung auf der linken Seite um +14 erweitern, entsteht eine wahre Aussage. Auf der linken Seite werden 14 H3O+-Ionen benötigt.
\begin{align*}
{Cr_2O_7^{2-}} \ + \ {6e^{-}} \ + \ 14 {H_3O^{+}} \rightarrow {2 Cr^{3+}}
\end{align*}
6. Stoffausgleich mit H2O
In Punkt drei haben wir bereits erwähnt, dass auf beiden Seiten des Reaktionspfeils am Ende die gleiche Anzahl an Atomen jeder Sorte stehen muss.
Wenn wir die Reaktionsgleichung betrachten, fällt auf, dass rechts weder Sauerstoff- noch Wasserstoff-Atome vorkommen. Diese können wir aber mithilfe von Wasser ergänzen. Dazu zählen wir die Anzahl der Sauerstoffatome auf der linken Seite.
\begin{array}{lr}
7 \ \text{Sauerstoff-Atome im Dichromat} & 7 \\
14 \ {H_3O^{+}} \text{mit jeweils einem Sauerstoff-Atom} & + 14 \\
\hline
\text{Anzahl der Sauerstoff-Atome links} & 21
\end{array}
Da in einem Wassermolekül ein Sauerstoff-Atom gebunden ist, benötigen wir auf der rechten Seite 21 Wassermoleküle.
\begin{align*}
{Cr_2O_7^{2-}} \ + \ {6e^{-}} \ + \ 14 {H_3O^{+}} \quad \rightarrow \quad 21 {H_2O} \ + \ {2 Cr^{3+}}
\end{align*}
Um alles noch einmal zu überprüfen, können wir die Anzahl der WasserstoffAtome auf beiden Seiten vergleichen. Diese müssen ebenfalls übereinstimmen. Sollte dies nicht der Fall sein, haben wir einen Fehler gemacht.
\begin{array}{lll}
\text{Links:} & 14 \ {H_3O^{+}} \text{mit je 3 Wasserstoff-Atomen} & 14 \cdot 3 = 42 \\
\text{Rechts:} & \text{21 Wassermoleküle mit je 2 Wasserstoff-Atomen} & 21 \cdot 2=42
\end{array}
Hier liegen auf beiden Seiten gleich viele Wasserstoff-Atome vor, also ist alles korrekt und die Reduktionsreaktion fertig.
Die erste Teilreaktion haben wir jetzt geschafft. Die Reaktion von Iodid zu Iod läuft nach demselben Prinzip ab.
1. Bestimmen der Oxidationszahlen
Iodid: I–
Auch hier gilt die Regel, dass alle Oxidationszahlen aufsummiert die Ladung des Teilchens ergeben müssen. Da hier nur ein Atom vorliegt, entspricht die Oxidationszahl dieses Atoms genau der Ladung des Ions, nämlich minus eins.
Iod: I2
Hier handelt es sich um das elementare Iod. Die Ladung beträgt hier Null, weshalb die Oxidationszahlen aufsummiert Null ergeben müssen. Da wir zwar zwei Atome gebunden haben, diese jedoch von der gleichen Sorte sind und somit die gleiche Oxidationszahl haben, muss die Oxidationszahl Null sein. Im Allgemeinen können wir sagen, dass Stoffe, die elementar vorliegen, immer die Oxidationszahl Null haben.
2. Bestimmen der Oxidation bzw. Reduktion
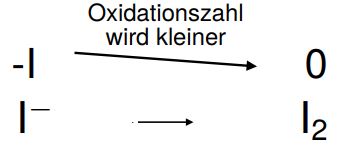
Von Iodid zu Iod ändert sich die Oxidationszahl von -I auf 0, wird also größer. Es handelt sich um Oxidation!
3. Mengenausgleich der oxidierten bzw. reduzierten Teilchen
Auf beiden Seiten des Reaktionspfeils müssen am Ende die gleiche Anzahl an Atomen jeder Sorte stehen (Massenerhaltung). Die Atomsorte, bei der sich die Oxidationszahl ändert, muss gleich zu Beginn ausgeglichen werden.
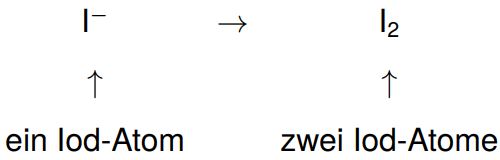
Da auf der rechten Seite zwei Iod-Atome stehen, benötigen wir auf der linken Seite auch zwei und gleichen mithilfe eines Koeffizienten aus.
4. Ausgleichen der Oxidationszahlen durch Elektronen
Die Oxidationszahlen werden erneut mithilfe von Elektronen ausgeglichen. Das können wir ebenfalls auf eine mathematische Gleichung übertragen, wobei wir darauf achten müssen, dass, wie bei der Reduktion, jeweils zwei Atome vorhanden sind und daher auch die Oxidationszahlen verdoppelt werden.
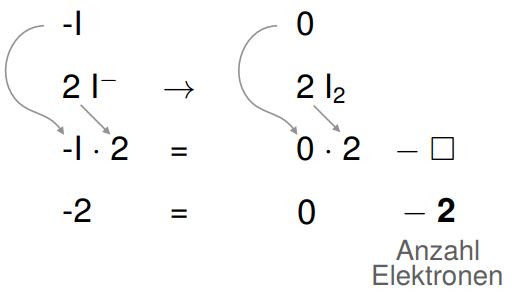
Indem wir die Gleichung auf der rechten Seite minus zwei addieren, entsteht die wahre Aussage, dass auf der rechten Seite zwei Elektronen benötigt werden.
\begin{align*}
{2I^{-}} \quad \rightarrow \quad {I_2} \ + {2e^{-}}
\end{align*}
5. Ausgleich der echten Ladung durch H3O+ -Ionen
Betrachten wir die echten Ladungen auf beiden Seiten, so stellen wir fest, dass sowohl auf der linken als auch auf der rechten Seite jeweils zwei negative Ladungen vorliegen. Die Ladungen stimmen dementsprechend überein und wir müssen nichts mehr ausgleichen.
6. Stoffausgleich mit H2O
In diesem Fall sind auch bereits alle Stoffmengen ausgeglichen, sodass nicht mehr mit Wasser ausgeglichen werden muss.
Jetzt haben wir beide Teilgleichungen, Reduktion und Oxidation, fertiggestellt. In einem letzten Schritt fassen wir nun die beiden Teilgleichungen zu einer Gesamtgleichung, der Redoxgleichung, zusammen.
7. Zusammenschreiben zur Redox-Gleichung
Da es sich bei einer Redoxreaktion um einen Elektronenübergang handelt, muss die Anzahl der an der Reaktion beteiligten Elektronen in der Reduktion und der Oxidation übereinstimmen. Dazu betrachten wir noch einmal die beiden Teilgleichungen:
\begin{array}{lccc}
\text{Red.:} & {Cr_2O_7^{2-}} \ + {6e^{-}} \ + 14 {H_3O^{+}} & \quad \rightarrow & \quad 21 \ {H_2O} \ + {2 Cr^{3+}} \\
\text{Ox.:} & {2I^{-}} & \quad \rightarrow & \quad {I_2} \ + \ {2 e^{-}}
\end{array}
Bei der Reduktion werden sechs Elektronen aufgenommen, bei der Oxidation jedoch nur zwei abgegeben. Daher muss die Oxidation dreimal ablaufen, sodass die Reduktion einmal ablaufen kann. Was bedeutet das für das Aufstellen der Redoxgleichung?
Die gesamte Oxidationsgleichung muss mit drei multipliziert werden, bei der Reduktion müssen wir nichts mehr tun.
\begin{array}{lcccl}
\text{Ox.:} & {2I^{-}} & \rightarrow & {I_2} \ + {2 e^{-}} & |\cdot 3 \\
& {6I^{-}} & \rightarrow & {3I_2} \ + {6 e^{-}} &
\end{array}
Jetzt haben wir bei beiden Teilgleichungen sechs Elektronen vorliegen und können alles als Ganzes zusammenschreiben:
\begin{align*}
{Cr_2O_7^{2-}} \ + {6e^{-}} \ + \ 14 \ {H_3O^{+}} \ + \ {6I^{-}} \rightarrow \ 21 \ {H_2O} \ + \ {2 Cr^{3+}} \ + \ {3I_2} \ + \ {6 e^{-}}
\end{align*}
Als allerletztes streichen wir alle Teilchen, die auf der linken und rechten Seite gleich sind, weg. Das machen wir, da die Teilchen nach der Reaktion unverändert vorliegen und entsprechend nicht an der Reaktion beteiligt sind. Somit werden sie einfach weggelassen. In diesem Fall gilt das lediglich für die Elektronen. Diese müssen unbedingt auf beiden Seiten wegfallen, da wir sonst beim Erweitern einen Fehler gemacht haben. Die Gesamtgleichung der Redoxreaktion lautet nach dem Wegstreichen der Elektronen:
\begin{align*}
{Cr_2O_7^{2-}} \ + 14 \ {H_3O^{+}} \ + \ {6I^{-}} \rightarrow \ 21 \ {H_2O} \ + \ {2 Cr^{3+}} \ + \ {3I_2}
\end{align*}
Hätten wir auf beiden Seiten Wasserteilchen und/oder Oxoniumionen, würden wir diese ebenfalls wegstreichen.
Beispiel:Betrachten wir die Reaktion von Methanol mit Dichromat zu Kohlenstoffdioxid und Chrom(III). Nachdem wir die einzelnen Teilgleichungen zu einer Gesamtgleichung zusammengefasst und die Elektronen weggestrichen haben, erhalten wir folgende Redoxgleichung, bei der wir noch die Wassermoleküle und die Oxoniumionen wegstreichen müssen, die nicht an der Reaktion beteiligt sind:
\begin{array}{rcll}
{CH_3OH} \ + \ {7H_2O} \ + \ {Cr_2O_7^{2-}} \ + \ {14 H_3O^{+}} \ & \rightarrow & {CO_2} \ + \ {6H_3O} \ + \ {2Cr^{3+}} \ + \ {21 H_2O } & \quad |-7 {H_2O} \\
{CH_3OH} \ + {Cr_2O_7^{2-}} \ + \ {14 H_3O^{+}} \ & \rightarrow & \ {CO_2} \ + \ {6H_3O} \ + \ {2Cr^{3+}} \ + \ {14 H_2O } & \quad |-6 {H_3O^{+}} \\
{CH_3OH} \ + \ {Cr_2O_7^{2-}} \ + \ {8 H_3O^{+}} \ & \rightarrow & \ {CO_2} \ + \ {2Cr^{3+}} \ + \ {14 H_2O } &
\end{array}